K3-RS01 T7高产量RNA合成试剂盒
一.试剂盒简介
RNA聚合酶通常用于合成大量RNA,是整个体外转录反应的灵魂,从根源上决定着体外转录(in vitro transcription, IVT)合成产物中mRNA质量的优劣。T7 RNA聚合酶具有转录率高、特异性强、保真度高等优势,是目前最为常用的启动子之一。本试剂盒是专为使用T7 RNA聚合酶体外转录RNA而设计的,搭配优化的体外转录体系,操作简单便捷,可实现高产量RNA转录物的合成和 修饰核苷酸的掺入,以获得高特异性的放射性标记RNA探针和加帽、生物素标记和染料标记的RNA。
本试剂盒每个标准反应(20 μL体系,1 μg模板)可以转录生成150-200 μg的RNA,转录合成的RNA适用于多方面的下游应用,如RNA结构和功能研究、反应RNA和RNAi实验、RNA酶保护、核酶生物化学、探针杂交和mRNA疫苗等。
二.试剂盒组分
试剂盒规格:50 Reactions
|
组分编号 |
组分名称 |
组分规格 |
储存条件 |
|
RS01-A |
Nuclease-free Water |
1 mL |
-20 ℃ |
|
RS01-B |
10X Reaction Buffer |
100 μL |
|
|
RS01-C |
ATP (100 mM) |
100 μL |
|
|
RS01-D |
UTP (100 mM) |
100 μL |
|
|
RS01-E |
GTP (100 mM) |
100 μL |
|
|
RS01-F |
CTP (100 mM) |
100 μL |
|
|
RS01-G |
T7 Enzyme Mix |
100 μL |
三.运输和储存
干冰运输。规定储存条件下2年有效,具体详见试剂盒标签。
四.操作流程
1.DNA模板制备
带有T7启动子的PCR产物、线性化的质粒DNA或合成的DNA片段都可以用作T7 High Yield RNA Synthesis Kit体外转录的模板。模板可用TE缓冲液或Nuclease-free Water溶解。图1显示了T7启动子序列、转录起始位点和T7转录后的RNA转录物。
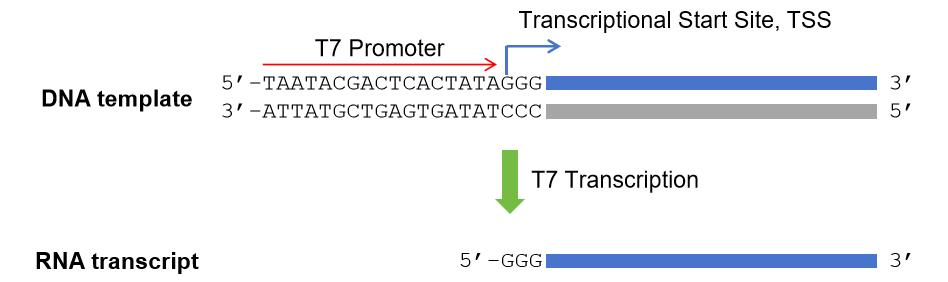
图1 T7 RNA聚合酶介导转录
Figure1 Transcription by T7 RNA Polymerase
(1) PCR产物模板
通过PCR扩增获得带有T7启动子的PCR产物可以作为体外 转录的模板。带有T7启动子的PCR产物可用通过在有义链的上游引物的5’端加T7启动子序列而获得。PCR产物推荐纯化后再使用,可获得更高的产量。
(2)线性化质粒模板
带有T7启动子的质粒可以作为体外转录的模板。模板DNA的质量影响转录率和合成RNA的完整性,高纯度的完全线性化的质粒模板是体外转录成功的关键。为了产生一定长度的RNA转录物,防止T7 RNA聚合酶转录过头,用作转录模板的质粒必须是线性化的。限制性酶切位点不一定是固定的,建议选择产生平头或5’突出的限制性内切酶。限制性酶切后的产物必须经过纯化,防止蛋白质、盐等污染抑制体外转录反应。
(3)合成的DNA片段模板
合成的DNA寡核苷酸,无论是完全双链还是大部分单链但T7启动子是双链的序列都可以作为本试剂盒的模板,即只要带有双链T7启动子序列的DNA模板都可以进行体外转录。通常,以合成DNA片段作为模板的产率较低,并且与合成寡核苷酸的顺序、纯度和制备方法等有关。
2.RNA合成方案
注意:建议佩戴手套和口罩,使用无核酸酶的试剂和离心管,避免RNA酶污染。标准反应为20 μL,如有需求可测试后进行放大。
(1)将试剂盒中的组分在冰上解冻,震荡混匀后瞬时离心至管底,冰上储存备用。
(2)在室温下按以下顺序配制反应混合液:
|
组分 |
加样量 |
终浓度 |
|
Nuclease-free Water |
up to 20 μL |
|
|
10X Reaction Buffer |
2 μL |
1X |
|
ATP (100 mM) |
2 μL |
10 mM |
|
UTP (100 mM) |
2 μL |
10 mM |
|
GTP (100 mM) |
2 μL |
10 mM |
|
CTP (100 mM) |
2 μL |
10 mM |
|
Template DNA |
X μL |
1 μg |
|
T7 Enzyme Mix |
2 μL |
|
|
总体积 |
20 μL |
|
注:如您需要进行多管反应,可先将10X Reaction Buffer和四种NTP溶液混合后配制预混液以供后续使用,每个标准反应中加入
10 μL预混液。
(3)将反应混合液充分混匀后瞬时离心至管底。37℃孵育2 h。根据需求可适当调整反应时间,如短片段的转录本(<300 nt)可增加孵育时间至4 h或更长时间。
注:反应过程中要避免溶液蒸发对反应体系的影响。
(4)(可选)在反应体系中加入1 μL的DNase I,37℃孵育15 min,消化转录的DNA模板。
注:相对于产物RNA,模板DNA的含量非常低,一般不用去除,也可以用DNase I消化。
(5)合成的RNA经电泳分析或纯化后进行定量检测,可用于下游实验。
注:通常来说,RNA产物浓度极高,需用Nuclease-free Water稀释后再检测。
1.RNA产物纯化
通常,通过标准RNA合成反应生成的未修饰RNA转录物可以通过苯酚-氯仿纯化法、柱纯化法、磁珠纯化法和氯化锂纯化法等方法进行纯化。
(1)苯酚-氯仿纯化法
苯酚-氯仿纯化可以去除蛋白质、大多数游离核苷酸和盐分。
A.加入160 μL Nuclease-free Water将产物溶液体积稀释至180 μL。
B.加入20 μL 3 M醋酸钠(pH 5.2)至稀释后的产物溶液中,充分混合均匀。
C.加入等体积的苯酚/氯仿混合液(1:1)进行抽提,室温或4℃ 10000 rpm离心5 min,取上层水相溶液 至新的Nuclease-free Ep管中。
D.加入与水等体积的氯仿进行2次抽提,每次都收集水相溶液至新的Nuclease-free Ep管中。
E.加入2倍体积的无水乙醇并混匀,-20℃孵育至少30 min,4℃ 12000 rpm离心10-15 min。
F.弃上清,加入500 μL预冷的70%乙醇,冲洗RNA沉淀,4℃ 12000 rpm离心后弃上清。
G.室温开盖干燥2-5 min,加入20-50 μL Nuclease-free Water或其他缓冲液溶解RNA沉淀。
H.纯化后的RNA样品可以进行电泳或定量等分析,长期保存请至于-80℃储存。
(2)柱纯化法
柱纯化可以去除蛋白、游离核苷酸和盐分。
加入80 μL Nuclease-free Water将产物溶液体积稀释至100 μL,充分混合均匀。再按柱纯化说明书进行纯化
注:标准反应产生的RNA量较高,可能超出结合柱的结合能力。纯化前请仔细阅读柱纯化说明书并对所需柱子数量进行预估。
(3)磁珠纯化法
磁珠纯化可以去除蛋白、 游离核苷酸和盐分。
按照磁珠纯化说明书进行纯化。
(4)氯化锂纯化法
氯化锂纯化可以去除蛋白质、大多数游离核苷酸和盐分。
A.向20 μL转录产物中分别加入30 μL Nuclease-free Water和30 μL 氯化锂沉淀溶液。
B.充分混合均匀,-20℃放置至少30 min。
C.12000 rpm离心15 min,弃上清,收集沉淀。
D.加入500 μL预冷的70%乙醇,冲洗RNA沉淀,4℃ 12000 rpm离心后弃上清,洗涤3次。
E.室温开盖干燥2-5 min,加入20-50 μL Nuclease-free water或其他缓冲液溶解RNA沉淀。
F.纯化后的RNA样品可以进行电泳或定量等分析,长期保存请至于-80℃储存。
2.RNA定量
(1)紫外吸收法
测量260 nm的紫外吸收值可以计算RNA浓度,但混合物中的游离核苷酸和模板DNA会影响定量的准确性。才有此方法进行定量前需先进行RNA纯化以去除转录反应中的游离核苷酸。吸光度读数应在分光光度计线性范围内给出,可根据需要对纯化后的RNA样品进行稀释后测定。RNA浓度在10 ng/μL – 3000 ng/μL范围内时,可以不经稀释直接用NanoDrop分光光度计读数。
对应单链RNA,A260下读值为1表示40 μg RNA/mL。样品RNA浓度(μg/mL)计算公式为:A260 ×稀释倍数× 40μg/mL= μg/mL RNA。
(2)染料法
用RiboGreen染料进行RNA定量,游离核苷酸不会影响定量,可以对纯化或未纯化的RNA产物进行准确定量。
五.常见问题&注意事项
1.质粒模板必须线性化么?
环状质粒或线性化的质粒均可作为T7 RNA聚合酶的模板。T7 RNA聚合酶可以围绕环状质粒模板转录多次而不解离。以环状质粒作为模板,由于没有有效的终止,易产生过长的RNA产物,故推荐将质粒先进行线性化,回收后再作为转录模板。
2.质粒模板线性化时,如何选择限制性内切酶?
质粒的线性化和纯度会影响转录的产量和RNA的完整性。为了得到特定长度的RNA,质粒可以用限制性内切酶线性化,产生平头末端或5'突出末端。因此,需要选择可以产生平头末端或5'突出末端的限制性内切酶,且模板DNA上不含有该限制性内切酶的识别序列。
3.T7 RNA聚合酶介导的转录反应需要引物吗?
不需要。T7 RNA聚合酶识别特定的启动子序列(5'-TAATACGACTCACTATA-3'),并在随后的G开始起始转录,然后T7 RNA聚合酶使用相反的链作为模板进行转录。
4.T7 RNA聚合酶可以以单链DNA为模板进行转录吗?
启动子序列区域必须是双链的,转录模板可以是单链也可以是双链。
5.使用T7 RNA聚合酶如何使RNA的产量最大化?
通过提高NTP/Mg2+浓度、DNA模板量和T7 RNA聚合酶的量,可以获得更高的RNA产率。雅心的T7高产量RNA合成试剂盒已经过优化,可用于合成高产量的RNA。
6.转录产物产量低或转录失败
(1)DNA模板中可能存在污染物(如高浓度的盐、有机溶剂等)抑制RNA聚合酶的活性,或者可能由于DNA 模板的浓度不正确。建议重新纯化模板,确定模板定量和完整性。
(2)体系中存在RNA酶污染,使RNA产物降解(Enzyme Mix中包含RNA酶抑制剂,可以防止大部分RNase污染所导致的RNA降解)。建议所用耗材和试剂均保证为RNase-free。
(3)DTT是RNA聚合酶活性所必须的,缓冲液时间过久或保存不当可能会导致DTT失效。建议适当补充新鲜 的DTT。
7.短转录本产量较低
短转录本(<0.3 kb)可通过延长反应时间或增加模板量来提高RNA产量。
8.RNA产物大于预期大小
(1)质粒模板可能未被完全线性化,即使少量的未被完全线性化的环状质粒,都能产生大量的长转录本。建议重新线性化质粒模板,确保质粒模板完全线性化,且线性化的片段为平头末端或5'突出末端。
(2)当RNA转录本由于产量过高或存在较强二级结构而不完全变性时,电泳图片上也可以观察到较大条带。建议稀释后电泳、加热完全变性RNA或采用变性胶检测RNA产物。
9.RNA产物小于预期大小
(1)模板序列中包含类似于T7 RNA聚合酶的终止序列,会导致RNA转录反应提前终止。建议更换RNA聚合酶尝试或更换模板序列。
(2)模板中存在高级结构,阻碍T7 RNA聚合酶的持续转录。建议加入SSB蛋白尝试或提高转录温度尝试。
(3)体系中存在RNase污染。建议所用耗材和试剂均保证为RNase-free。



